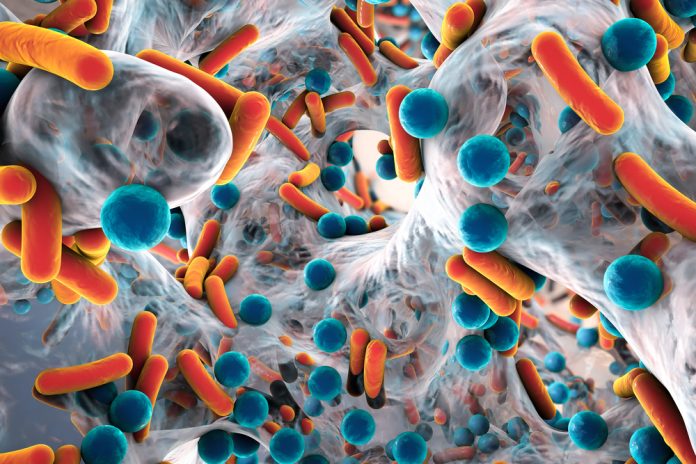
Roma, 19 febbraio 2026 (Agenbio) – I ricercatori della Facoltà di Scienze Biologiche dell’Università della California a San Diego hanno sviluppato una nuova tecnologia, basata su CRISPR, per rimuovere gli elementi resistenti agli antibiotici dalle popolazioni di batteri. Il metodo è simile ai gene drive che vengono applicati alle popolazioni di insetti per interrompere la diffusione di proprietà nocive, come i parassiti che causano la malaria. Il nuovo strumento Pro-Active Genetics (Pro-AG), denominato pPro-MobV, è una tecnologia di seconda generazione che utilizza un approccio simile per disattivare la resistenza ai farmaci nelle popolazioni di batteri. «Con pPro-MobV abbiamo trasferito il concetto di gene-drive dagli insetti ai batteri come strumento di ingegneria di popolazione – ha affermato Ethan Bier, professore del Dipartimento di Biologia Cellulare e dello Sviluppo -. Con questa nuova tecnologia basata su CRISPR, possiamo prendere alcune cellule e lasciarle agire per neutralizzare l’AR in un’ampia popolazione target». Bier e i suoi colleghi hanno sviluppato un sistema di follow-on che diffonde i componenti della cassetta antibiotica CRISPR tramite trasferimento coniugale, un processo simile all’accoppiamento nei batteri. Come descritto sulla rivista npj Antimicrobials and Resistance, i ricercatori hanno dimostrato che questo sistema pPro-MobV di nuova generazione può sfruttare un tunnel di accoppiamento batterico creato naturalmente tra le cellule per diffondere gli elementi chiave debilitanti. Hanno dimostrato che il processo funziona all’interno dei biofilm batterici, comunità di microrganismi che contaminano varie superfici e possono essere estremamente difficili da rimuovere con i metodi di pulizia convenzionali. I biofilm contribuiscono anche alla diffusione di malattie e si formano nella maggior parte delle infezioni che portano a malattie gravi, in parte perché aiutano a combattere gli antibiotici creando uno strato protettivo di cellule attraverso il quale gli antibiotici difficilmente si diffondono. La nuova tecnologia ha quindi un potenziale in ambito sanitario, nella bonifica ambientale e nell’ingegneria del microbioma. I ricercatori hanno anche scoperto che i componenti del sistema genetico attivo potrebbero essere trasportati e distribuiti dai batteriofagi, o fagi, virus che sono concorrenti evolutivi naturali dei batteri. I fagi vengono progettati appositamente per combattere la resistenza agli antibiotici eludendo le difese batteriche e inserendo fattori di disturbo all’interno delle cellule. Gli elementi pPro-MobV, secondo i ricercatori, funzionerebbero in combinazione con tali virus fagici ingegnerizzati. (Agenbio) Etr 12:00
- Federazione
- Servizi
- Leggi-Normative
- Legislazione Nazionale
- Accreditamento
- Alimenti
- Ambiente
- Bioetica
- Cosmetici
- ECM
- Erboristeria
- Farmacologia
- Formazione
- Laboratorio Analisi
- Lavoro
- Leggi Finanziarie
- Liberi Professionisti
- Piano Sanitario Nazionale
- Privacy
- Professione
- Pubblicità Sanitaria
- Qualità
- Servizio Sanitario Nazionale
- Sicurezza sul Lavoro
- Specializzazioni e loro equipollenze
- Università
- Veterinaria
- Legislazione Regionale
- Legislazione Nazionale
- FAQ
- Contatti
- Avvisi
- MY BIO
- Coordinamenti Nazionali
- ORDINI REGIONALI
- FORMAZIONE
Copyright © 2023 Federazione Nazionale degli Ordini dei Biologi, All Rights Reserved.